Amyloid β protein
Amyloid beta (Aβ or Abeta) denotes peptides of 36–43 amino acids that are the main component of the amyloid plaques found in the brains of people with Alzheimer's disease. The peptides derive from the amyloid precursor protein (APP), which is cleaved by beta secretase and gamma secretase to yield Aβ. Aβ molecules can aggregate to form flexible soluble oligomers which may exist in several forms. It is now believed that certain misfolded oligomers (known as "seeds") can induce other Aβ molecules to also take the misfolded oligomeric form, leading to a chain reaction akin to a prion infection. The oligomers are toxic to nerve cells. The other protein implicated in Alzheimer's disease, tau protein, also forms such prion-like misfolded oligomers, and there is some evidence that misfolded Aβ can induce tau to misfold.
The normal function of Aβ is not well understood. Though some animal studies have shown that the absence of Aβ does not lead to any obvious loss of physiological function, several potential activities have been discovered for Aβ, including activation of kinase enzymes, protection against oxidative stress, regulation of cholesterol transport, functioning as a transcription factor, and anti-microbial activity (potentially associated with Aβ's pro-inflammatory activity).
The glymphatic system clears metabolic waste from the mammalian brain, and in particular amyloid beta. Indeed, a number of proteases have been implicated by both genetic and biochemical studies as being responsible for the recognition and degradation of amyloid beta; these include insulin degrading enzyme.and presequence protease. The rate of removal is significantly increased during sleep. However, the significance of the lymphatic system in Aβ clearance in Alzheimer's disease is unknown.
対象は Amyloid β protein
製品は Amyloid β protein
- Cat.No. 商品名 インフォメーション
-
GC37984
β-Amyloid (1-42), rat
β-アミロイド (1-42)、ラットは 42-aa ペプチドであり、急性海馬切片に対して細胞毒性効果を示し、アルツハイマー病の研究に使用されています。

-
GC61988
β-amyloid (12-28) (TFA)

-
GC37986
β-Amyloid 1-17
β-アミロイド 1-17 は、β-アミロイドのペプチドであり、繊維を安定化し、Aβ 繊維の形成に関与します。

-
GC37987
β-Amyloid 1-20
β-アミロイド 1-20 は、ベータ アミロイド タンパク質のアミノ酸 1 から 20 で構成されます。

-
GC37990
β-Amyloid 1-34
β-アミロイド1-34は、34個のアミノ酸からなるβ-アミロイドペプチドです。

-
GC37993
β-Amyloid 1-9
β- アミロイド 1-9、ベータ アミロイドの N 末端フラグメントは、アミノ酸残基 1 から 9 で構成されます。
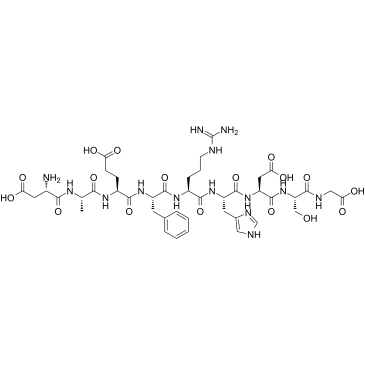
-
GC37985
β-Amyloid 11-22
β-アミロイド 11-22 は、β-アミロイドのペプチド断片です。
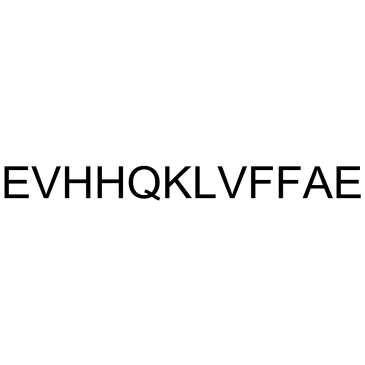
-
GC37988
β-Amyloid 12-20
β-アミロイド 12-20 は、β-アミロイドのペプチド断片です。
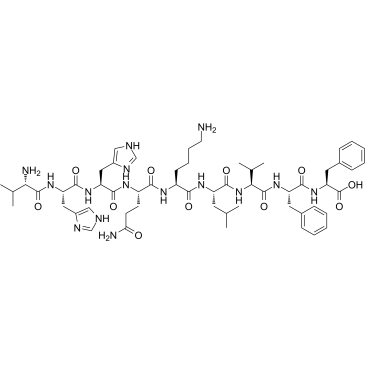
-
GC37989
β-Amyloid 13-27
β-アミロイド13-27は、ベータアミロイドタンパク質の13から27のアミノ酸からなるペプチドです。
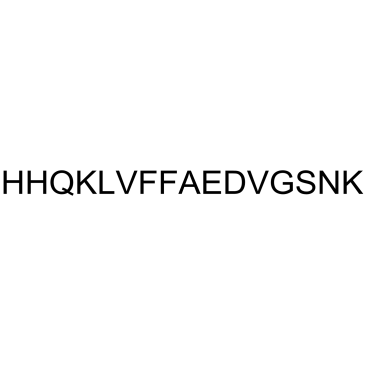
-
GC39466
β-Amyloid 15-21

-
GC37991
β-Amyloid 15-21
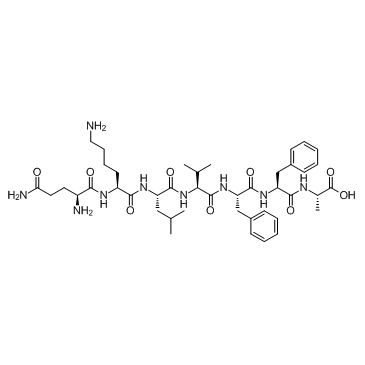
-
GC37992
β-Amyloid 18-28
β-アミロイド 18-28 は、β-アミロイドのペプチド断片です。
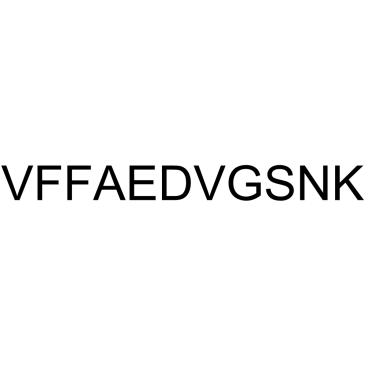
-
GC37994
β-Amyloid 22-40
β-アミロイド 22-40 は、β-アミロイドのペプチド断片です。
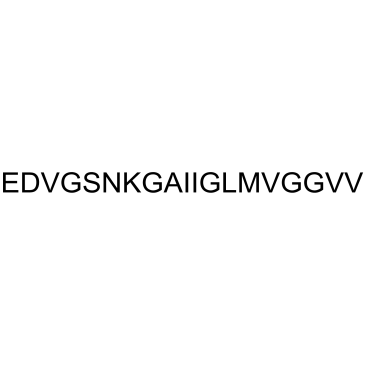
-
GC37995
β-Amyloid 33-40
β- アミロイド 33-40 は、ベータ アミロイド タンパク質の 33 から 40 のアミノ酸からなるペプチドです。
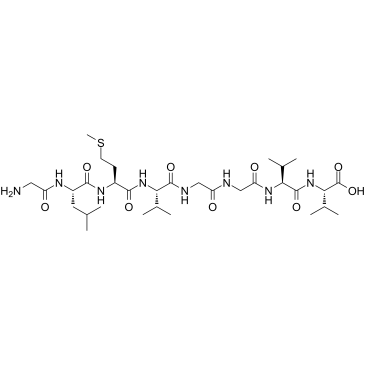
-
GC37996
β-Amyloid 35-42
β- アミロイド 35-42 は、ベータ アミロイド タンパク質の 35 から 42 のアミノ酸からなるペプチドです。
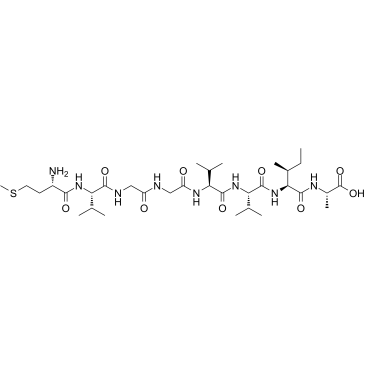
-
GC37997
β-Amyloid 4-10
β-アミロイド 4-10 は、ポリクローナル抗 Aβ(1-42) 抗体のエピトープであり、トランスジェニック アルツハイマー病マウス モデルにおけるアミロイド沈着を減少させます。
-
GC37998
β-Amyloid Protein Precursor 770 135-155
β-アミロイドタンパク質前駆体 770 135-155 は、アミロイド前駆体タンパク質アイソフォーム (APP 770) のペプチドです。

-
GC34242
β-Amyloid (1-42), rat TFA
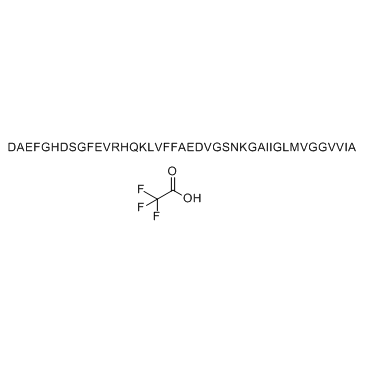
-
GC31146
β-Amyloid (10-35), amide
&β;-アミロイド (10-35)、アミドは 26 個の aa (Aβ ペプチドの 10-35 残基) で構成され、アルツハイマー病のアミロイド斑の主要成分です。

-
GC31129
β-Amyloid 1-16 (Amyloid β-Protein (1-16))
&ベータ;-アミロイド 1-16 (アミロイド &ベータ;-タンパク質 (1-16)) は、β-金属結合に関与するアミロイドタンパク質フラグメントです。

-
GC31171
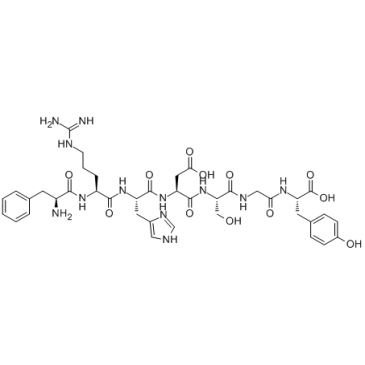
β-Amyloid 1-28 (Amyloid β-Protein (1-28))
β-Amyloid 1-28 (Amyloid β-Protein (1-28)) は、金属結合に関与する β-Amyloid タンパク質フラグメントです。
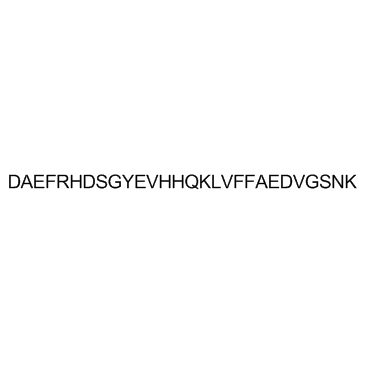
-
GC34391
β-Amyloid 15-21 (Beta-Amyloid (15-21))
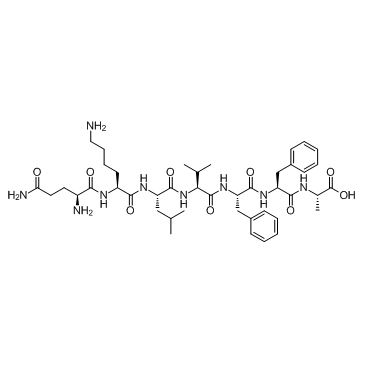
-
GC30325
β-Amyloid 22-35 (Amyloid β-Protein (22-35))
β-アミロイド 22-35 (アミロイド β-タンパク質 22-35)、β-アミロイドタンパク質の残基 22-35 フラグメントは、無血清培地中のラット海馬からの培養ニューロンに対して細胞傷害効果を有する。

-
GC31137
β-Amyloid 29-40 (Amyloid beta-protein(29-40))
&ベータ;-アミロイド 29-40 (アミロイド ベータタンパク質(29-40)) は、アミロイド-β のフラグメントです。ペプチド。

-
GC31179
β-Amyloid 31-35
β-アミロイド 31-35 は、神経毒性活性を保持するネイティブ アミロイド-β ペプチドの最短配列です。
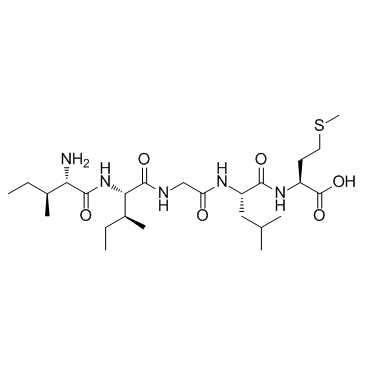
-
GA20024
(7-Diethylaminocoumarin-3-yl)carbonyl-Amyloid β-Protein (1-40)
フルオレセント染料(7-ジエチルアミノクマリン-3-イル)カルボニル(DACまたはDEAC)でN末端修飾されたアミロイドβタンパク質(1-40)。この誘導体は、元のペプチドと非常に似た振る舞いをするため、さまざまな膜に対するアミロイドβタンパク質(1-40)の結合特性を評価するために利用できます。水溶液中では蛍光色素はほとんど蛍光しないが、膜への結合により蛍光強度が増加します(λex = 430 nm、λem = 470 nm)。リピッド二重層内のGM1ガングリオシドおよびコレステロール含有量の増加は、このペプチドの結合を促進しました。リン酸コリンおよびリン酸セリンでは親和性は観察されませんでした。

-
GA20029
(Arg¹³)-Amyloid β-Protein (1-40)
H13Rは、Abetaの金属結合領域における変異であり、その銅介在毒性を低下させます。この位置にアルギニンを含むネイティブなロッド状動物配列は、人間のアミロイドペプチドよりも金属に対して耐性が高いです。

-
GA20030
(Arg⁶)-Amyloid β-Protein (1-40)
β-アミロイドペプチドの英語(H6R)変異は、プロトフィブリル形成を増加させることなく線維化を加速します。小野らによれば、英語および鳥取変異は、最初の段階である単量体折りたたみおよびオリゴマー化においてAbeta集合体を変化させ、野生型オリゴマーよりも神経細胞培養物に対して毒性が高いオリゴマーを生成します。 His? からArgへの交換はAβペプチドによって形成されるCu(II)錯体の構造に影響を与えます。

-
GA20038
(Asn²³)-Amyloid β-Protein (1-40)
アミロイドβ(Aβ)40のIowa(D23N)変異体は、WT Aβ配列よりも溶液中で繊維を形成する速度がかなり速く、これらの繊維は増加した毒性に責任がある可能性がある異なる構造を示しています。

-
GA20039
(Asn⁶⁷⁰,Leu⁶⁷¹)-Amyloid β/A4 Protein Precursor₇₇₀ (667-675)
SEVNLDAEFは、早期発症アルツハイマー病を持つスウェーデンの家族で見つかったアミロイド前駆体タンパク質(APP)の変異接合部分のシーケンスに対応し、「スウェーデン」変異(K670N/M671L)と呼ばれています。このペプチドは、カテプシンGおよびキモトリプシンによるロイシン-アスパラギン酸切断の測定に使用されましたが、カテプシンB、D、Lではどちらも生成物が観察されませんでした。

-
GA20040
(Asn⁶⁷⁰,Leu⁶⁷¹)-Amyloid β/A4 Protein Precursor₇₇₀ (667-676)
このペプチド基質は、アミロイド前駆体タンパク質(APP)のβ-シークレージサイトの'Swedish' Lys-Met/Asn-Leu (K670N/M671L)変異に対応しています。これは、β-シークレーゼ活性を測定するために使用されています。

-
GA20041
(Asn⁶⁷⁰,Sta⁶⁷¹,Val⁶⁷²)-Amyloid β/A4 Protein Precursor₇₇₀ (662-675)
ヒト脳からのアミロイド前駆体タンパク質(APP)β-シークレターゼは、アミロイドβ-タンパク質(Aβ)配列のアミノ末端でフルレングスのAPPを切断し、それによりβ-切断可能な可溶性APPと対応する細胞関連カルボキシ末端フラグメントが生成されて細胞外に放出されます。その後、C末端フラグメントがγ-シークレターゼによって切断されることでAβが形成されます。この新しいペプチドは、IC50 = 30 nMを持つAPP β-シークレターゼの強力な基質アナログ阻害剤です。

-
GA20042
(Asn⁷)-Amyloid β-Protein (1-40)
β-アミロイドペプチドの鳥取(D7N)変異は、プロトフィブリル形成を増加させることなく線維化を加速します。小野らは、英語と鳥取の変異がAbetaアセンブリーの最初期段階である単量体折りたたみおよびオリゴマー化を変え、野生型オリゴマーよりも神経細胞培養に対してより毒性の高いオリゴマーを生成することを示しました。

-
GA20045
(Asp³⁷)-Amyloid β-Protein (1-42)
G37D変異体は、WT Abeta42の凝集挙動や神経毒性を示しません。

-
GA20053
(Cys²⁶)-Amyloid β-Protein (1-40)
Aβ40 S26Cは、共有結合されたAβ40ホモ二量体を生成するために使用されています。ジマー化は、β-メルカプトエタノールで可溶性のジマーを還元することで簡単に逆転させることができます。 Aβ40 S26Cは蛍光タグでラベリングするのに完璧に適しています。

-
GA20052
(Cys²⁶)-Amyloid β-Protein (1-40) (Dimer)
H-7402の二量体。

-
GA20050
(Cys⁰)-Amyloid β-Protein (1-40)
Cys-Aβ1-40は、フィブリル形成に関与する配列を影響せずに、マレイミド化学によって簡単かつ選択的に修飾、ラベル付け、キャリアとカップリングされることができます。ペプチドの自由メルカプト基は金表面に密着します。

-
GA20095
(Des-Glu²²)-Amyloid β-Protein (1-40)
大阪変異体は、APPとAβにおいて最初の欠失型変異である。Aβ E22delta ミュータントは、2つの主要なAβ-分解酵素であるネプリシンとインスリン分解酵素による分解に対してより耐性があります。合成ミュータント Aβ は、強化されたオリゴマー化を示すがフィブリル化はしない異常な凝集特性を示しました。また、野生型 Aβ よりも海馬長期増強を効率的に抑制します。E693delta 変異を含む APP を持つトランスジェニックマウスモデルが開発されました。APP(OSK)-Tg マウスでは、8か月の時点で細胞内 Aβ E22delta オリゴマーと記憶障害が観察されます。

-
GA20096
(Des-Glu²²)-Amyloid β-Protein (1-42)
アミロイドβの大阪(E22delta)変異体は、βシート変換、ラジカル生成、およびシナプトトキシシティを促進しますが、神経毒性は促しません。

-
GA20182
(Gln²²)-Amyloid β-Protein (1-40)
アミロイドβペプチドのオランダ変異体(E22Q)は、野生型ペプチドよりもより容易に凝集し、その結果得られるフィブリルは神経毒性が増加します。変異ペプチドE22Qは、濃度25μmで脳内皮細胞のアポトーシスを誘発しましたが、WT Aβ1-40およびイタリア変異体E22K(H-6698)には影響がありませんでした。

-
GA20183
(Gln²²)-Amyloid β-Protein (1-42)
オランダ変異体(E22Q)は野生型配列よりもより容易に凝集します。その結果、線維は神経毒性が増加します。

-
GA20184
(Gln²²,Asn²³)-Amyloid β-Protein (1-40)
脳内にヒトAβ前駆体タンパク質の血管性ダッチ/アイオワ(E693Q/D694N)変異体を発現する遺伝子組み換えマウス(Tg-SwDI)は、豊富な脳微小血管フィブリルアミロイド沈着物を蓄積し、強力な神経炎症を示します。in vitroでは、二重変異したAβペプチドは、ダッチとアイオワ単一変異体に比べてフィブリル化傾向と病原性が増加していました。

-
GA20181
(Gln¹¹)-Amyloid β-Protein (1-28)

-
GA20186
(Gln⁹)-Amyloid β-Protein (1-40)

-
GA20199
(Gly²²)-Amyloid β-Protein (1-40)
高度に神経毒性のある北極変異体(E22G)Aβは、可溶性および不溶性のβ-アミロイド集合体形成のメカニズムを研究するために使用されています。野生型Aβと同様に、北極変異体はGM1ガングリオシドが存在する場合に優先的に集合します。

-
GA20200
(Gly²²)-Amyloid β-Protein (1-42)
北極変異体のアミロイドβペプチド1-42において、Glu178がGlyに置換されたものは、野生型Aβ 1-42よりも明らかにアミロイド原性が高くなっています。

-
GA20197
(Gly²¹)-Amyloid β-Protein (1-40)
22番目の位置で変異したβ-アミロイドペプチド(Dutch、Italian、Arctic mutants)とは対照的に、Flemish変異体(A21G)は凝集する傾向が低く、神経毒性も低下しています。BettsとTsubukiの研究では、A21Gは野生型Aβ 1-40およびE22変異体よりもneprilysinによって有意に遅く分解されました。プロテアーゼ分解に対する相対的な耐性は、Aβ変異体の病原性を説明することができます。

-
GA20198
(Gly²¹)-Amyloid β-Protein (1-42)
フレミッシュ変異体(A21G)は凝集する傾向が低く、神経毒性も低下しています。 A21Gは病原性があります。なぜなら、WT Abeta42よりもネプリリシンによって著しく遅く分解されるためです。

-
GA20201
(Gly²⁸,Cys³⁰)-Amyloid β-Protein (1-30) amide

-
GA20244
(Lys²²)-Amyloid β-Protein (1-40)
β-アミロイド1-40のイタリア変異体(E22K)は、野生型配列1-40よりもより迅速に凝集します。Masudaらによる固相NMR研究によれば、マイナー構造体でLys²²とAsp²³の間に塩基橋が形成されたことが増加した神経毒性の原因である可能性があります。アークティック、フレミッシュ、オランダ変異体と同様に、イタリア変異体はネプリシンによって野生型Aβよりもかなり遅く分解されます。

-
GA20245
(Lys²²)-Amyloid β-Protein (1-42)
イタリア変異体(E22K)は野生型配列よりもより迅速に凝集します。

-
GA20242
(Lys¹⁵)-Amyloid β-Protein (15-21)
KKLVFFAには、フルレングスアミロイドβ-タンパク質を結合する最小シーケンスであるKLVFFシーケンスが含まれています。H-3682のKLVFFと比較して、改善された水溶性を示しました。これは、フルレングスアミロイドβ-タンパク質内の定義されたシーケンスをスクリーニングするためのラベル付きプローブとして使用できます。

-
GA20251
(Met(O)³⁵)-Amyloid β-Protein (1-40)
Met35の酸化はAβ40オリゴマーの形成を抑制します。

-
GA20252
(Met(O)³⁵)-Amyloid β-Protein (1-42)
(Met(O)³?)-アミロイドβ-タンパク質(1-42)(H-5888)は、Aβ 1-42(H-1368)とは対照的に、9〜11日齢のラット胎児海馬ニューロン培養に対して非毒性であり、タンパク質の酸化を引き起こさないことが示されています。また、Met(O)³?によってフィブリル形成が影響を受けないことも実証されています。Nleアナログについては、H-7308を参照してください。

-
GA20253
(Met(O)³⁵)-Amyloid β-Protein (25-35)
アルファβのスルホキシド 25-35。

-
GA20254
(Met(O₂)³⁵)-Amyloid β-Protein (1-42)
マイティらは、野生型Aβ(1-42)と同様に有毒で凝集しやすいことがわかった一方、Aβ(1-42)のスルホキシドに対してスルホンは同じく有毒であり、同じ速度で凝集することが示されました。

-
GA20259
(Nle³⁵)-Amyloid β-Protein (1-40)
Met³の反応性チオエーテルは、Aβ1-40およびAβ1-42の活性に重要です。不活性なNleによるMetの置換により、M35Nle Aβ1-40は培養された海馬ニューロンに対して毒性を示さず、タンパク質カルボニル残基のレベルにほとんど影響を与えませんでした。 Nleペプチドは同じ傾向を示しましたが、スルホキシド形成が必要なランダムコイルからβシートへの構造転移を妨げました。

-
GA20260
(Nle³⁵)-Amyloid β-Protein (1-42)
Met³のチオエーテルは、Aβ1-42によって誘発される酸化ストレスとその神経毒性に重要な役割を果たします。ノールロイシンアナログのAβ1-42 M35Nleは、神経毒性が欠けているものの、形態学的には元の配列と区別できないフィブリルを形成します。

-
GA20283
(Pyr³)-Amyloid β-Protein (3-40)
Aβ40(H-7422)およびAβ42(H-4796)から派生したピログルタミン酸修飾アミロイド-βペプチドは、AD脳内での豊富な存在、高い凝集性、安定性、細胞毒性により、アルツハイマー病(AD)の病理学的重要な役割を果たす可能性があるとして注目されています。カテプシンBの作用によりAβ40および42はN末端切断されることがあります。Glu179の環化はグルタミニルシクラーゼによって触媒されます。したがって、これらの酵素の阻害はAD治療法として有効な手段である可能性があります。

-
GA20285
(Pyr³)-Amyloid β-Protein (3-42)

-
GA20284
(Pyr³)-Amyloid β-Protein (3-42)
(Pyr179)-アミロイドβタンパク質(3-42)は、アルツハイマー病およびダウン症患者の人間の脳に沈着する主要なアミロイドβペプチド構造であることがわかっています。したがって、(Pyr179)-Aβ(3-42)は脳内に蓄積され、不溶性のアミロイドβペプチド沈着物の形成を引き起こす可能性があります。 Nussbaumらは、切断されたAβ配列のプリオン様行動とtau依存性細胞毒性を研究しました。

-
GA20282
(Pyr¹¹)-Amyloid β-Protein (11-40)
pEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVというアミロイドβタンパク質(Aβ)のN末端が切り取られた異形体で、11番目のピログルタミン酸(Pyr)残基から始まるものを用いて、フィブリロゲニシスに関連する螺旋形成の一般性を研究した実験が行われました。多くの臨床的に重要なアミロイドβタンパク質アロフォームのフィブリロゲニシス動力学を比較すると、これらペプチドの中で(Pyr185)-アミロイドβタンパク質(11-40)が最もフィブリル化速度を遅延させることが観察されました。

-
GA20309
(Thr²)-Amyloid β-Protein (1-42)
APPのβ-シークレターゼ切断部位に非常に近い変異。アイスランドのAβ42のA2T変異は、ネイティブ配列よりも病原性が低いことが判明しました。前駆体APP A673Tは、アルツハイマー病リスクを減らす最初の人間由来のAPPバリアントでした。A2Tもγ-シークレターゼ切断に影響を与え、細胞ベースの試験では効率的な基質ではありませんでした。

-
GA20339
(Val²)-Amyloid β-Protein (1-42)
APP(A673V)のβ-シークレターゼ切断部位に非常に近い変異。アイスランドの保護的なA2T変異とは対照的に、劣性のA2V変異はアルツハイマー病のリスクを増加させる可能性があります。Cantuらは、APP A673Vが同型遺伝子個体ではAD型認知症の早期発症と関連している一方、異型遺伝子状態では保護効果があることを観察しました。

-
GA20340
(Val²)-Amyloid β-Protein (1-6)

-
GA20341
(Val³⁴)-Amyloid β-Protein (1-40)
脳性アミロイド血管症(CAA)は、アルツハイマー病で一般的に見られる現象であり、80%以上の場合にアミロイド-Aβ血管沈着が特徴となっています。21-23の位置における変異(例えばオランダ変異E22Q)は主にCAAと関連していますが、認知症または脳出血という驚くべき異なる臨床表現を示します。この「hot spot」以外にあるPiedmont L34V Aβ変異体も同様の出血性フェノタイプを示し、よく研究されているオランダ変異体よりも穏やかです。

-
GA20433
5-FAM-Amyloid β-Protein (1-40)
5-FAM-アミロイド β-タンパク質 (1-40) は、FAM 蛍光標識 β- アミロイド (1-40) ペプチド (Λex=492nm および Λem=518nm) です。

-
GA20435
5-FAM-Amyloid β-Protein (1-42)

-
GA20434
5-FAM-Amyloid β-Protein (1-42) (scrambled)
H-1368、H-6466、H-8146用の蛍光染料標識された非活性コントロール。

-
GC42505
5-FAM-Amyloid-β (1-28) Peptide (human) (trifluoroacetate salt)
5-FAM-Amyloid-β(1-28)ペプチドは蛍光標識されたペプチドです。

-
GC40130
5-FAM-Amyloid-β (1-42) Peptide (human) (trifluoroacetate salt)
5-FAM-Amyloid-β(1-42)ペプチドは、蛍光標識されたアミロイドβペプチドです。

-
GA20440
5-TAMRA-Amyloid β-Protein (1-40)
アンダーソンとウェブは、蛍光色素のTAMRAやその他の蛍光色素を用いたAβ40のN末端ラベリングが、様々な幅のプロトフィブリルやアミロイド線維形成を防止しないことを透過型電子顕微鏡で確認することができました。

-
GA20441
5-TAMRA-Amyloid β-Protein (1-42)

-
GA20448
Abz-(Asn⁶⁷⁰,Leu⁶⁷¹)-Amyloid β/A4 Protein Precursor₇₇₀ (669-674)-EDDnp
オルトアミノベンゾイル(Abz)/N-(2,4-ジニトロフェニル)エチレンジアミン(EDDnp)グループをドナー/アクセプターペアとして含む分子内消光蛍光基質。これは、β-シークレターゼBACE(β-サイトAPP切断活性)によって標的化されたスウェーデン変異体(JMV2236)のβ-アミロイド前駆体タンパク質(βAPP)配列に対応します。このFRET基質は、カテプシンD、ディスインテグリンおよびメタロプロテアーゼ10(ADAM10)、腫瘍壊死因子α変換酵素(TACE)、プレセニリン1(PS1)またはプレセニリン2(PS2)よりもBACE1およびBACE2によって選択的に切断されます。

-
GA20452
Abz-Amyloid β/A4 Protein Precursor₇₇₀ (669-674)-EDDnp
オルトアミノベンゾイル(Abz)/N-(2,4-ジニトロフェニル)エチレンジアミン(EDDnp)グループをドナー/アクセプターペアとして含む分子内消光蛍光基質。これは、β-シークレターゼBACE(β-site APP-cleaving activity)によって標的化された野生型(JMV2235)β-アミロイド前駆体タンパク質(βAPP)配列を模倣しています。このFRET基質は、BACE1、BACE2、カテプシンDによって切断されます。

-
GA20453
Abz-Amyloid β/A4 Protein Precursor₇₇₀ (708-715)-Lys(Dnp)-D-Arg-D-Arg-D-Arg amide
死後の非アルツハイマー病およびアルツハイマー病人間脳分離物からγ-シークレターゼを解析するために開発された感度の高い蛍光(FRET)基質。

-
GA20525
Acetyl-(N-Me-Leu¹⁷,N-Me-Phe¹⁹)-Amyloid β-Protein (16-20) amide
Aβ(1-40)フィブリロゲン化の膜透過性阻害剤。

-
GA20526
Acetyl-(Pro¹⁸,Asp²¹)-Amyloid β-Protein (17-21) amide
ペンタペプチドAc-LPFFD-NH?(iAβ5p)は、小規模な化学修飾によってプロテアーゼ分解に対する安定性が向上した製品H-4876のアナログです。 iAβ5pはβシートブレイカーペプチドとして機能し、脳が選択的に取り込むために知られているほとんどのタンパク質やペプチドよりも高い速度で血液脳関門を越えることができます。そのため、このペプチドは特異的に脳へ輸送されていると考えられています。また、2つの異なるトランスジェニックアルツハイマー病(AD)モデルでは、iAβ5pによって神経細胞の生存率が有意に増加し、アミロイド斑の減少と関連する脳炎の低下も報告されています。

-
GA20535
Acetyl-Amyloid β-Protein (1-6) amide
Aβ42のサブペプチドを用いた実験により、Yingらが説明した抗体A8によって同定されたエピトープは、Aβの1-6領域内に存在することが明らかになった。この抗体は、分子量16.5〜25 kDaの可溶性Aβ42オリゴマーに高い親和性を示し、老化促進SAMP 8マウスの脳部位からも標的抗原を検出した。アミダ化またはアセチル化およびアミダ化された配列形式は、例えばKaliszanらが報告した逆相高速液体クロマトグラフィー(HPLC)保持時間予測などの定量的構造保持関係(QSRR)実験に使用されました。

-
GA20534
Acetyl-Amyloid β-Protein (15-20) amide
Ac-QKLVFF-NH?をアミロイドβ-プロテイン(1-40)と培養することで、アミロイドβ-プロテイン(1-40)のアミロイド線維への重合が抑制されました。このペプチドは、重合部位をブロックすると考えられています。

-
GA20533
Acetyl-Amyloid β/A4 Protein Precursor₇₇₀ (96-110) (cyclized)
この環化ペプチドは、APPのヘパリン結合ドメインに類似しており、ヘパリンに強く結合し、¹²?I標識されたAPPのヘパリンへの結合を阻害します(IC??= 10??M)。このペプチドは、神経突起成長に対するAPPの硫酸グリコサミノグリカンプロテオグリカン依存性刺激効果をブロックします。

-
GC35334
Amyloid β Peptide (42-1)(human)
アミロイド βペプチド (42-1)(ヒト) は、アミロイド β の不活性型です。ペプチド (1-42)。

-
GC35335
Amyloid β-peptide (1-40) rat
アミロイド β-ペプチド (1-40) ラットは、アミロイド β-ペプチドのラット型であり、ニューロンの周囲に不溶性の細胞外沈着物として蓄積し、アルツハイマー病 (AD) に関連する老人斑を引き起こします。

-
GA20721
Amyloid β-Protein (1-12)

-
GA20722
Amyloid β-Protein (1-14)
N末端のAβフラグメントであるAβ1-14、Aβ1-15(H-6368)、およびAβ1-16(H-2958)は、γシークレターゼ阻害剤治療に応答して細胞培地およびCSF中で増加します。これらの小さなペプチドの存在は、βシークレターゼによるアミロイド前駆体タンパク質のカタボリックな切断経路に沿ったものです。 Aβ1-14、Aβ1-15、およびAβ1-16が量依存的に増加することが示されていますが、Aβ1-42レベルは変化しません。

-
GA20724
Amyloid β-Protein (1-24)

-
GA20725
Amyloid β-Protein (1-37)
アミロイド β-タンパク質 (1-37) は、アルツハイマー病のミニ精神状態検査 (MMSE) スコアと適度に相関します。

-
GA20726
Amyloid β-Protein (1-38)
Aβ(25-35)(H-1192)と同様に、Aβフラグメント(1-38)はカルシウムホメオスタシスを不安定化し、人間の皮質ニューロンを環境的な攻撃に対して脆弱にします。

-
GA20727
Amyloid β-Protein (1-39)
CSFにはAβ40が最も豊富なAβホモログと共に、少量のAβ37、38、39およびN末端切断アミロイドペプチドが検出されます。相対的な量はアルツハイマー病の変異型に依存します。C末端切断アミロイドペプチドもアミロイド斑に見られます。

-
GA20728
Amyloid β-Protein (1-40) (scrambled)

-
GA20729
Amyloid β-Protein (1-40) amide

-
GA20733
Amyloid β-Protein (1-42)
内部塩と比較して、Aβ42のHCl塩はpH7.4でより容易に凝集します。

-
GA20730
Amyloid β-Protein (1-42) (HFIP-treated)
H-7442は、HFIP中にAmyloid β-Protein (1-42) (H-1368)を溶解し、文献に記載されているようにアリクオットし、溶媒を除去して得られました。

-
GA20731
Amyloid β-Protein (1-42) (scrambled)

-
GA20736
Amyloid β-Protein (1-43)
アミロイド β-タンパク質 (1-43) は、長い間知られている Aβ1-42 よりも凝集しやすく、毒性が高い.

-
GA20737
Amyloid β-Protein (1-46)
分泌性アミロイドβタンパク質(1-40)および(1-42)の前駆体。アミロイドβタンパク質(1-46)の同定により、アミロイドβ前駆体タンパク質(APP)の膜貫通領域内で既知のγ−切断部位とε−切断部位の間にゼータ−切断部位があることが明らかになった。

-
GA20738
Amyloid β-Protein (1-6)
Aβ42のサブペプチドを用いた実験により、Yingらによって説明された抗体A8が同定したエピトープは、Aβ42の1-6領域内に存在することが明らかになった。この抗体は、分子量16.5〜25 kDaの可溶性Aβ42オリゴマーに高い親和性を示し、老化促進SAMP 8マウスの脳部位からも標的抗原を検出した。

-
GA20739
Amyloid β-Protein (1-6) amide
Aβ42のサブペプチドを用いた実験により、Yingらが説明した抗体A8によって同定されたエピトープは、Aβの1-6領域内に存在することが明らかになった。この抗体は、分子量16.5〜25 kDaの可溶性Aβ42オリゴマーに高い親和性を示し、老化促進SAMP 8マウスの脳部位からも標的抗原を検出した。アミダ化またはアセチル化およびアミダ化された配列形式は、例えばKaliszanらが報告した逆相高速液体クロマトグラフィー(HPLC)保持時間予測などの定量的構造保持関係(QSRR)実験で使用されました。

-
GA20720
Amyloid β-Protein (10-35)
アミロイドβタンパク質(10-35)、YEVHHQKLVFFAEDVGSNKGAIIGLMは、高分解能構造研究のために完全な長さのアミロイドβタンパク質(1-40)および(1-42)の切り詰めペプチドモデルとして使用されました。完全な長さのアミロイドβタンパク質とは異なり、アミロイドβタンパク質(10-35)は定義されたpH、イオン強度、可溶性ペプチド濃度を持つ水溶液から均一なフィブリル形成を制御可能で再現性があります。これらは高分解能構造研究に必要です。

-
GA20723
Amyloid β-Protein (11-42)



