Peptides
製品は Peptides
- Cat.No. 商品名 インフォメーション
-
GC33788
Adrenocorticotropic Hormone (ACTH) (18-39), human (CLIP (human))
副腎皮質刺激ホルモン (ACTH) (18-39)、ヒト (CLIP (ヒト)) は、コルチコトロピン様中間葉ペプチドであり、下垂体中間葉のメラノトローフで産生されます。

-
GC65059
Adrenocorticotropic Hormone (ACTH) (18-39), human TFA
副腎皮質刺激ホルモン (ACTH) (18-39)、ヒト TFA はコルチコトロピン様中間葉ペプチドであり、下垂体中間葉のメラノトローフで産生されます 。
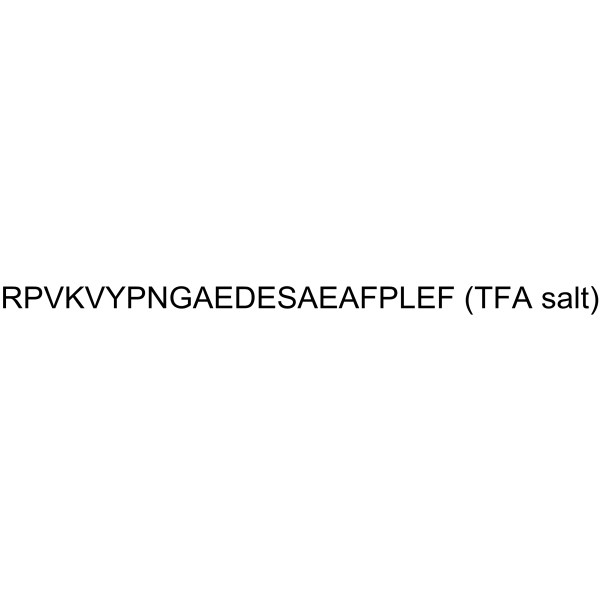
-
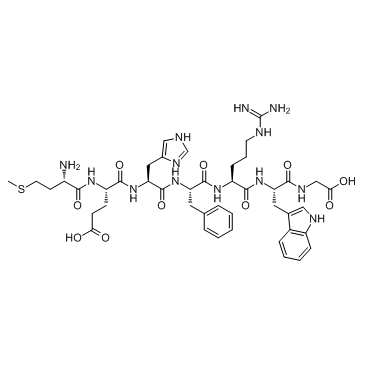
GC33790
Adrenocorticotropic Hormone (ACTH) (4-10), human
副腎皮質刺激ホルモン (ACTH) (4-10)、ヒトはメラノコルチン 4 (MC4R) 受容体アゴニストです。
-
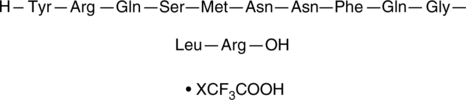
GC42737
Adrenomedullin (1-12) (human) (trifluoroacetate salt)
アドレノメドリン(1-12)は、アドレノメドリン(1-52)のN末端フラグメントです。
-
GC34230
Adrenomedullin (1-50), rat
アドレノメデュリン (1-50)、ラットは 50 アミノ酸のペプチドであり、CGRP1 受容体の活性化を介して選択的な動脈血管拡張を誘導します。

-
GC35256
Adrenomedullin (11-50), rat
アドレノメデュリン (11-50)、ラットは、ラット アドレノメデュリンの C 末端フラグメント (11-50) です。

-
GC42738
Adrenomedullin (13-52) (human) (trifluoroacetate salt)
アドレノメドリン(13-52)は、アドレノメドリン(1-52)の切り詰められた形です。

-
GC35257
Adrenomedullin (16-31), human
アドレノメデュリン (16-31)、ヒトは、ヒト アドレノメデュリン (hADM) のアミノ酸残基 16-31 フラグメントです。

-
GC42741
Adrenomedullin (22-52) (human) (trifluoroacetate salt)
アドレノメドリン(22-52)は、アドレノメドリン(1-52)のC末端フラグメントです。

-
GC33955
Adrenomedullin (AM) (1-52), human
アドレノメデュリン (AM) (1-52)、ヒトは、がんの細胞増殖と血管新生に影響を与える 52 アミノ酸のペプチドです。

-
GC32622
Adrenomedullin (AM) (13-52), human
アドレノメデュリン (AM) (13-52)、ヒトは、内皮依存性血管拡張剤として作用する 40 アミノ酸のペプチドです。

-
GC32615
Adrenomedullin (AM) (22-52), human (22-52-Adrenomedullin (human))
アドレノメデュリン (AM) (22-52)、ヒト (22-52-アドレノメデュリン (ヒト))、NH2 末端切断型アドレノメデュリン アナログは、アドレノメデュリン受容体アンタゴニストであり、後肢血管のカルシトニン遺伝子関連ペプチド (CGRP) 受容体とも拮抗します。猫のベッド。

-
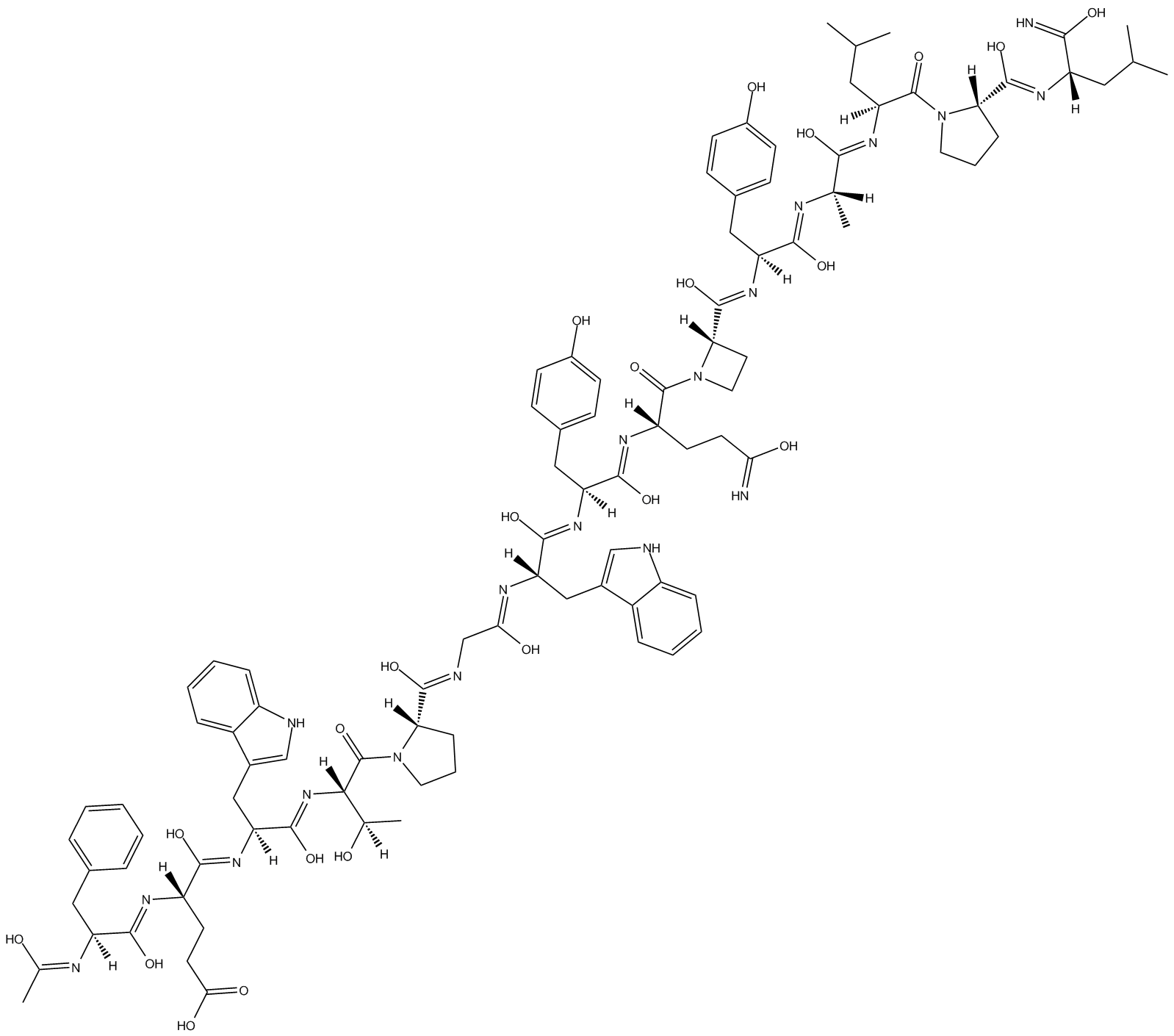
GC11039
AF 12198
AF 12198 は、ヒト I 型インターロイキン 1 受容体 (IL1-R1) (IC50=8 nM) に対する強力で選択的かつ特異的なペプチドアンタゴニストですが、ヒト II 型受容体 (IC50=6.7 μM) やマウス I 型受容体 ( IC50>200 μM)。
-
GC35264
AGA-(C8R) HNG17, Humanin derivative
AGA-(C8R) HNG17、ヒューマニン誘導体は強力なヒューマニン (HN) 誘導体です。
-
GC61526
AGA-(C8R) HNG17, humanin derivative TFA
AGA-(C8R) HNG17、ヒューマニン誘導体 TFA は強力なヒューマニン (HN) 誘導体です。

-
GC14867
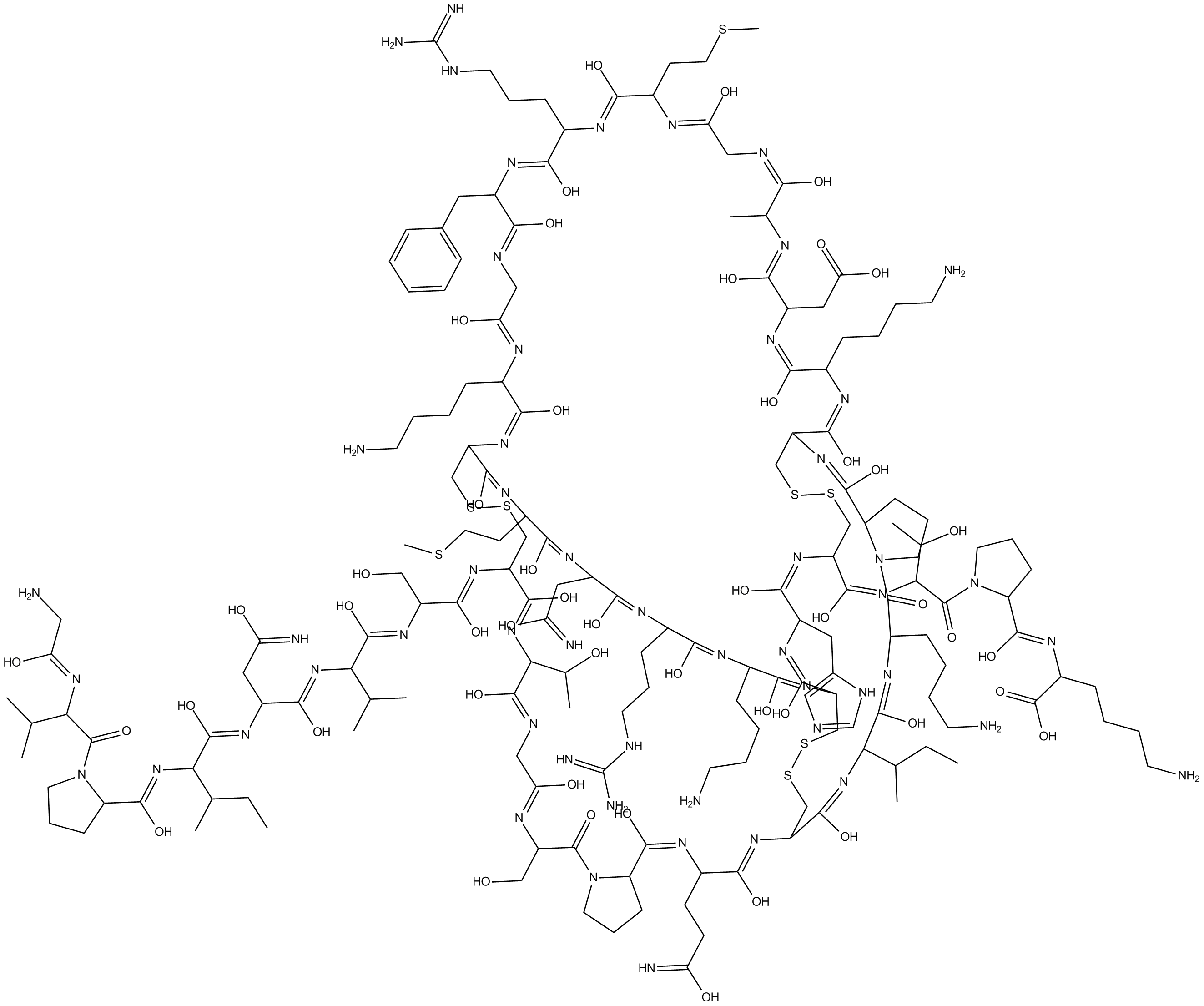
Agitoxin 2
Agitoxin 2 は K+ チャネル阻害剤であり、mKV1.3 と mKV1.1 の IC50 値はそれぞれ 201 pM と 144 pM です)。
-
GC15822
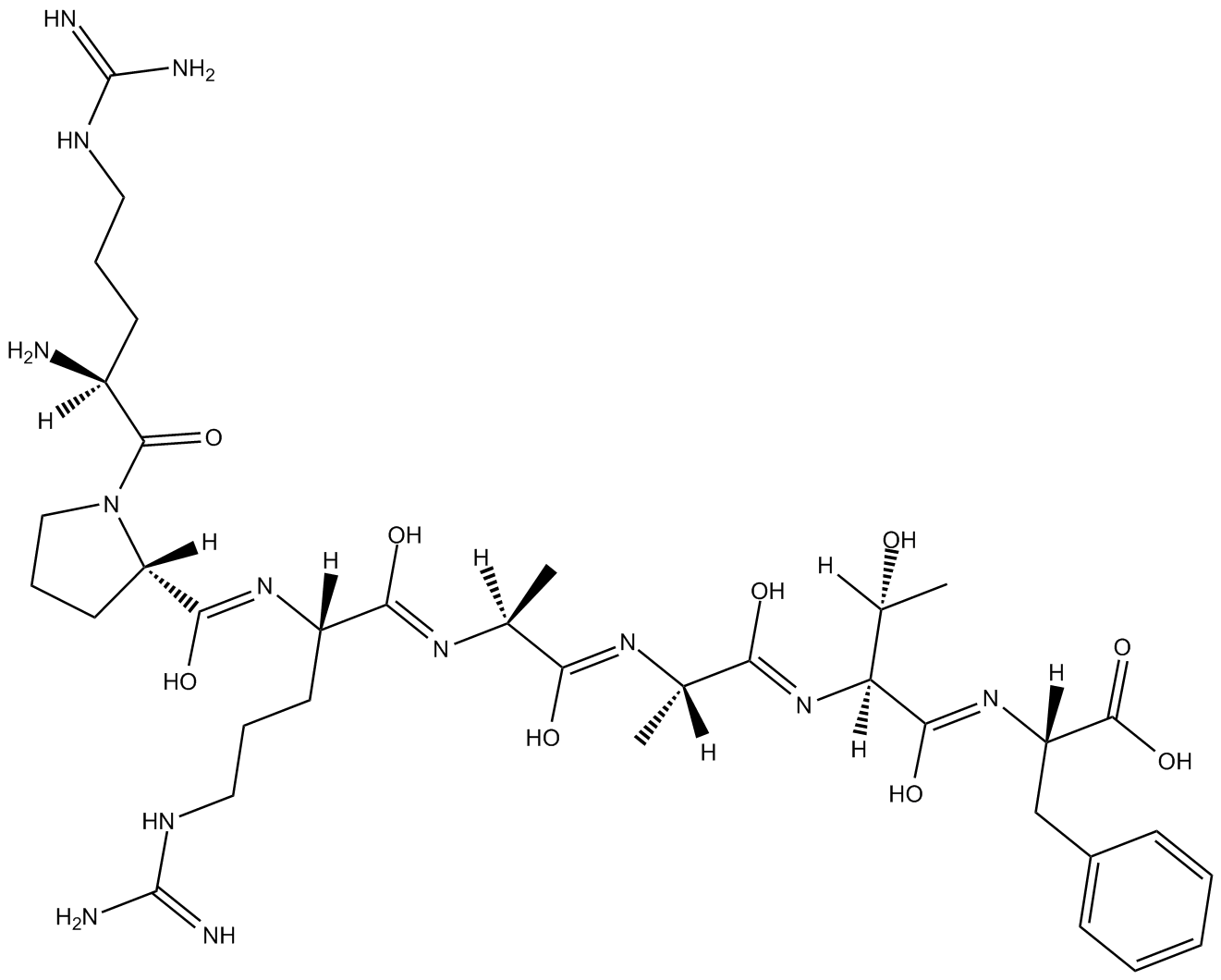
Akt/SKG Substrate Peptide
Akt/SKG基質ペプチドは、p70S6KまたはMAPK1によってリン酸化されないAkt/PKBの基質として適した合成ペプチドです。
-
GC35282
Alexamorelin Met 1
-
GC19584
Alkaline Phosphatase
アルカリホスファターゼは、塩基性 pH 値でリン酸モノエステルの加水分解を触媒する膜結合糖タンパク質です。
-
GC35291
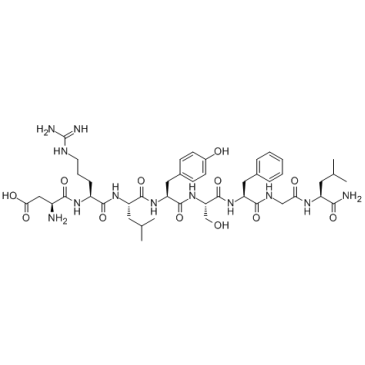
Allatostatin II
アラトスタチン II はデカペプチドです。

-
GC35292
Allatostatin IV
アラトスタチン IV はオクタペプチドです。
-
GC30940
Allergen Gal d 4 (46-61), chicken (Lysozyme C (46-61) (chicken))
アレルゲン Gal d 4 (46-61)、ニワトリ (リゾチーム C (46-61) (ニワトリ)) は、鶏卵白のリゾチームペプチドです。

-
GC35304
Alpha 1(I) Collagen (614-639), human
アルファ 1(I) コラーゲン (614-639)、ヒトは、アルファ 1 タイプ I コラーゲンのペプチド断片です。
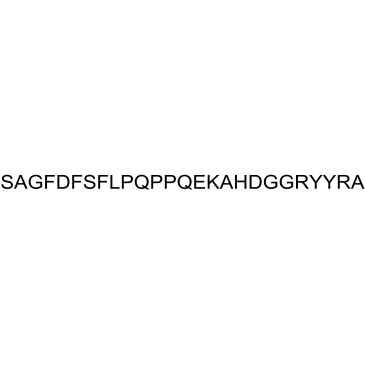
-
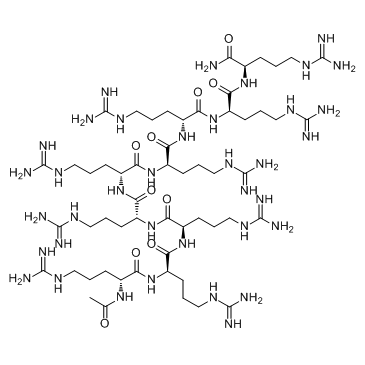
GC32208
ALX 40-4C
ALX 40-4C は、ケモカイン受容体 CXCR4 の小さなペプチド阻害剤であり、SDF-1 が CXCR4 に結合するのを 1 μM の Ki で阻害し、HIV-1 の X4 株の複製を抑制します。 ALX 40-4C トリフルオロアセテートは APJ 受容体のアンタゴニストとしても機能し、IC50 は 2.9 μM です。
-
GC34386
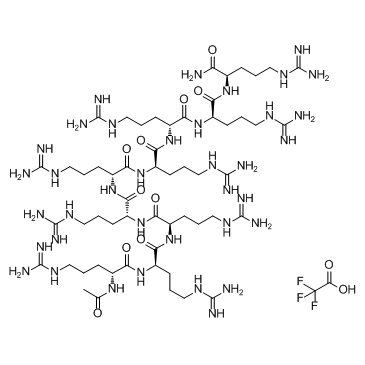
ALX 40-4C Trifluoroacetate
ALX 40-4C トリフルオロ酢酸塩は、ケモカイン受容体 CXCR4 の小さなペプチド阻害剤であり、SDF-1 が CXCR4 に結合するのを 1 μM の Ki で阻害し、HIV-1 の X4 株の複製を抑制します。 ALX 40-4C トリフルオロアセテートは APJ 受容体のアンタゴニストとしても機能し、IC50 は 2.9 μM です。
-
GC49262
Alytesin (trifluoroacetate salt)
多様な生物学的活性を持つ神経ペプチド
-
GC30514
AMARA peptide
AMARA ペプチドは、SIK および AMPK の基質です。

-
GC34224
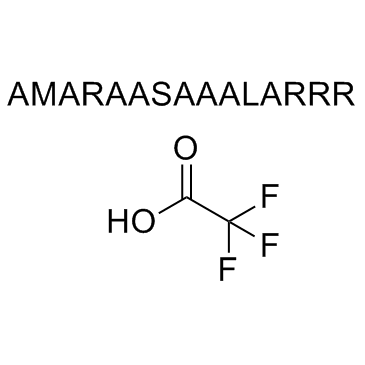
AMARA peptide TFA
AMARA ペプチド (TFA) は、塩誘導性キナーゼ (SIK) およびアデノシン一リン酸活性化プロテインキナーゼ (AMPK) の基質です。
-
GC35324
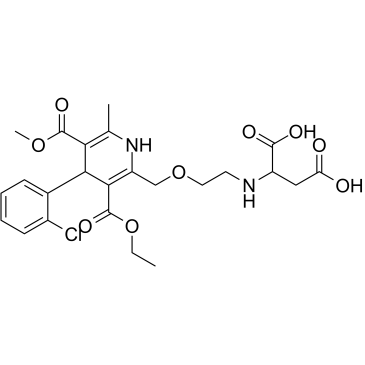
Amlodipine aspartic acid impurity
アムロジピン アスパラギン酸不純物は、アムロジピン アスパラギン酸の不純物です。
-
GC16513
Amylin
37 アミノ酸ポリペプチドであるアミリンは、インスリンと共分泌される膵臓ホルモンであり、代謝とグルコースの恒常性において独自の役割を果たします。

-
GA20710
Amylin (8-37) (human)
ヒトIAPP(8-37)、ATQRLANFLVHSSNNFGAILSSTNVGSNTYアミドは、容易に体外でフィブリルを形成します。

-
GC35331
Amylin (8-37), rat
アミリン (8-37)、ラットは、筋肉組織におけるインスリン関連のグルコース取り込みおよびグリコーゲン沈着を選択的に阻害するネイティブ アミリンの短縮型類似体です。

-
GA24066
Amylin (free acid) (human)

-
GC42796
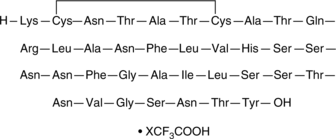
Amylin (human) (trifluoroacetate salt)
アミリンは、膵臓β細胞から分泌される37個のアミノ酸ペプチドホルモンであり、食物摂取を減らし、グルカゴン分泌を低下させ、胃排出を遅くし、満腹感を増加させます。
-
GC35332
Amylin (IAPP), feline
ネコ科のアミリン (IAPP) は、ネコ由来の 37 アミノ酸のポリペプチドです。

-
GC60581
Amylin (IAPP), feline TFA
アミリン (IAPP)、ネコ TFA は、ネコ由来の 37 アミノ酸ポリペプチドです。

-
GC35333
Amylin, amide, rat
アミリン、アミド、ラットは、アミリン受容体 AMY1 および AMY3 受容体、およびさまざまな形で AMY2 受容体の強力で高親和性のリガンドです。結合研究は、一般的に後者の受容体に使用されます。

-
GC35334
Amyloid β Peptide (42-1)(human)
アミロイド βペプチド (42-1)(ヒト) は、アミロイド β の不活性型です。ペプチド (1-42)。

-
GC35335
Amyloid β-peptide (1-40) rat
アミロイド β-ペプチド (1-40) ラットは、アミロイド β-ペプチドのラット型であり、ニューロンの周囲に不溶性の細胞外沈着物として蓄積し、アルツハイマー病 (AD) に関連する老人斑を引き起こします。

-
GA20721
Amyloid β-Protein (1-12)

-
GA20722
Amyloid β-Protein (1-14)
N末端のAβフラグメントであるAβ1-14、Aβ1-15(H-6368)、およびAβ1-16(H-2958)は、γシークレターゼ阻害剤治療に応答して細胞培地およびCSF中で増加します。これらの小さなペプチドの存在は、βシークレターゼによるアミロイド前駆体タンパク質のカタボリックな切断経路に沿ったものです。 Aβ1-14、Aβ1-15、およびAβ1-16が量依存的に増加することが示されていますが、Aβ1-42レベルは変化しません。

-
GA20724
Amyloid β-Protein (1-24)

-
GA20725
Amyloid β-Protein (1-37)
アミロイド β-タンパク質 (1-37) は、アルツハイマー病のミニ精神状態検査 (MMSE) スコアと適度に相関します。

-
GA20726
Amyloid β-Protein (1-38)
Aβ(25-35)(H-1192)と同様に、Aβフラグメント(1-38)はカルシウムホメオスタシスを不安定化し、人間の皮質ニューロンを環境的な攻撃に対して脆弱にします。

-
GA20727
Amyloid β-Protein (1-39)
CSFにはAβ40が最も豊富なAβホモログと共に、少量のAβ37、38、39およびN末端切断アミロイドペプチドが検出されます。相対的な量はアルツハイマー病の変異型に依存します。C末端切断アミロイドペプチドもアミロイド斑に見られます。

-
GA20728
Amyloid β-Protein (1-40) (scrambled)

-
GA20729
Amyloid β-Protein (1-40) amide

-
GA24067
Amyloid β-Protein (1-40)-Lys(biotinyl) amide
Aβ40の固定化には。

-
GA20733
Amyloid β-Protein (1-42)
内部塩と比較して、Aβ42のHCl塩はpH7.4でより容易に凝集します。

-
GA20730
Amyloid β-Protein (1-42) (HFIP-treated)
H-7442は、HFIP中にAmyloid β-Protein (1-42) (H-1368)を溶解し、文献に記載されているようにアリクオットし、溶媒を除去して得られました。

-
GA20731
Amyloid β-Protein (1-42) (scrambled)

-
GA24068
Amyloid β-Protein (1-42)-Lys(biotinyl) amide
Aβ42の固定化には。

-
GA20736
Amyloid β-Protein (1-43)
アミロイド β-タンパク質 (1-43) は、長い間知られている Aβ1-42 よりも凝集しやすく、毒性が高い.

-
GA20737
Amyloid β-Protein (1-46)
分泌性アミロイドβタンパク質(1-40)および(1-42)の前駆体。アミロイドβタンパク質(1-46)の同定により、アミロイドβ前駆体タンパク質(APP)の膜貫通領域内で既知のγ−切断部位とε−切断部位の間にゼータ−切断部位があることが明らかになった。

-
GA20738
Amyloid β-Protein (1-6)
Aβ42のサブペプチドを用いた実験により、Yingらによって説明された抗体A8が同定したエピトープは、Aβ42の1-6領域内に存在することが明らかになった。この抗体は、分子量16.5〜25 kDaの可溶性Aβ42オリゴマーに高い親和性を示し、老化促進SAMP 8マウスの脳部位からも標的抗原を検出した。

-
GA20739
Amyloid β-Protein (1-6) amide
Aβ42のサブペプチドを用いた実験により、Yingらが説明した抗体A8によって同定されたエピトープは、Aβの1-6領域内に存在することが明らかになった。この抗体は、分子量16.5〜25 kDaの可溶性Aβ42オリゴマーに高い親和性を示し、老化促進SAMP 8マウスの脳部位からも標的抗原を検出した。アミダ化またはアセチル化およびアミダ化された配列形式は、例えばKaliszanらが報告した逆相高速液体クロマトグラフィー(HPLC)保持時間予測などの定量的構造保持関係(QSRR)実験で使用されました。

-
GA20720
Amyloid β-Protein (10-35)
アミロイドβタンパク質(10-35)、YEVHHQKLVFFAEDVGSNKGAIIGLMは、高分解能構造研究のために完全な長さのアミロイドβタンパク質(1-40)および(1-42)の切り詰めペプチドモデルとして使用されました。完全な長さのアミロイドβタンパク質とは異なり、アミロイドβタンパク質(10-35)は定義されたpH、イオン強度、可溶性ペプチド濃度を持つ水溶液から均一なフィブリル形成を制御可能で再現性があります。これらは高分解能構造研究に必要です。

-
GA20723
Amyloid β-Protein (11-42)

-
GA20740
Amyloid β-Protein (16-20)
KLVFFは、全長アミロイドβタンパク質に結合する最小の配列に対応します。このペンタペプチドは、βシートブレーカーとして機能します。

-
GA20741
Amyloid β-Protein (16-22)
自己組織化Aβ配列。

-
GA20742
Amyloid β-Protein (17-40)
APPはα-シークレターゼとγ-シークレターゼによる切断(すなわち非アミロイド原性経路)によって、p3ペプチド、つまりAβ17-40およびAβ17-42の混合物が生成されます。 p3はAD脳で観察される拡散性斑点およびダウン症候群の影響を受けた人々の前アミロイド斑点の主要成分です。

-
GA24069
Amyloid β-Protein (17-42)
APPはαシークレターゼとガンマシークレターゼによって切断されます(i.

-
GA20744
Amyloid β-Protein (2-42)
Aβ2-42は、前頭側頭型認知症(FTD)などの他の変性性認知症とアルツハイマー病を区別するためのバイオマーカーになる可能性があります。このペプチドは、マクロファージによる貪食作用を促進します。

-
GA20743
Amyloid β-Protein (20-29)
FAEDVGSNKG。

-
GA20745
Amyloid β-Protein (25-35) amide
アミロイドβタンパク質(25-35)のアミダ化により、アミロイドβタンパク質(25-35)のアミロイド形成能力が強く低下した生成物が得られました。一方、神経毒性活性はペプチドの凝集状態に依存しないことがわかりました。

-
GA20747
Amyloid β-Protein (3-40)

-
GA20748
Amyloid β-Protein (3-42)
ADが進行するにつれて、N末端切断されたAβ42が増加して形成される可能性があります。 Aβ3-42はPyrペプチドの前駆体です。 (Pyr²)-Aβ3-42陽性斑点は、高い安定性と凝集傾向のため、年齢依存的な分解に耐性を示す可能性があります。

-
GA20746
Amyloid β-Protein (33-42)
GLMVGGVVIAは、Aβ1-42に対する抗体を作るために使用されるβアミロイドタンパク質の部分配列です。Liらは、この配列および他のAβ1-42 C末端フラグメントの凝集挙動を研究しました。

-
GA20749
Amyloid β-Protein (35-25)
Aβ 25-35の逆順序、非活性コントロール。

-
GA20750
Amyloid β-Protein (36-38)

-
GA20751
Amyloid β-Protein (37-39)

-
GA20754
Amyloid β-Protein (4-42)
Aβ 4-42は、AD脳に沈着する最も早期かつ顕著なAβ種の1つである可能性があります。アミロイドプラークコアのシーケンシングでは、分離されたAβの64%がN末端にフェニルアラニンを持っていました。さらに、IP / MS実験では、AD患者で主要なAβ種としてAβ 4-42が同定されました。加えて、V261I PS1変異を有する家族性AD患者の綿毛プラークの成分としても発見されました。また、血管性認知症や家族性デンマーク認知症患者からもアミロイド沈着物中で発見されました。これらの観察結果から、Aβ 4-42は多くのCNS疾患の発展に貢献する可能性があることが示唆されています。

-
GA20753
Amyloid β-Protein (40-1)
非アクティブなコントロール

-
GA20752
Amyloid β-Protein (40-1)
Aβ 1-40の逆順序。
(Note: Aβ 1-40 refers to a specific protein fragment associated with Alzheimer's disease.)
-
GA20755
Amyloid β-Protein (5-42)
アミロイド前駆体タンパク質からカスパーゼの作用によって生成されるAbeta 5-42は、アルツハイマー病の脳でも沈着しますが、凝集しにくいです。

-
GA20756
Amyloid β-Protein (6-20)

-
GA20718
Amyloid β/A4 Protein Precursor₇₇₀ (667-676)
ペプチド基質APP(667-676)、SEVKMDAEFRは、野生型アミロイド前駆体タンパク質(APP)β-シークレターゼ切断部位に対応しています。 SEVKMDAEFRは、β-シークレターゼ活性の測定に使用されています。

-
GA20719
Amyloid β/A4 Protein Precursor₇₇₀ (740-770)
アミロイドβ/A4タンパク質前駆体(740-770)は、C末端アミロイド前駆体タンパク質(APP)フラグメントであるC31に対応します。このフラグメントは、caspase-8および-9によるAPPのプロテオリシス的切断によって細胞内で生成されます。C31は神経細胞に対してプロアポトーシス効果とサイトトキシック効果を持ち、アルツハイマー病(AD)患者の脳内に存在することが示されています。培養細胞では、アミロイドβタンパク質によってAPPのcaspase切断が誘導され、その後のC31の生成がアミロイドβタンパク質と関連した細胞死(apoptotic cell death) に貢献しました。増加しているセルサイクル蛋白であるアミロイド前駆体結合タンパク質BP1(APP-BP1)は、AD脳内で増加しており、APP誘導性apoptosisを媒介するためにAPPのC31領域と結合することが示されています。

-
GP10118
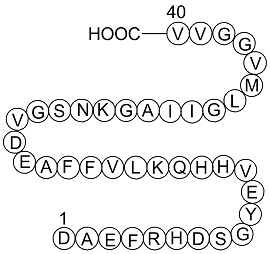
Amyloid Beta-Peptide (1-40) (human)
アミロイドβペプチド(1-40)(人間)、(C194H295N53O58S1)、配列H2N-DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA-OHを持つペプチドで、分子量は4329.8です。アミロイドβ(AβまたはAbeta)は、アミロイド前駆体タンパク質から処理された36〜43個のアミノ酸のペプチドです。
-
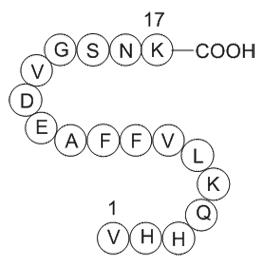
GP10049
Amyloid Beta-Peptide (12-28) (human)
Amyloid Beta-Peptide (12-28) (human) is a peptide fragment of amyloid beta protein (1-42) (Aβ (1-42)).
-
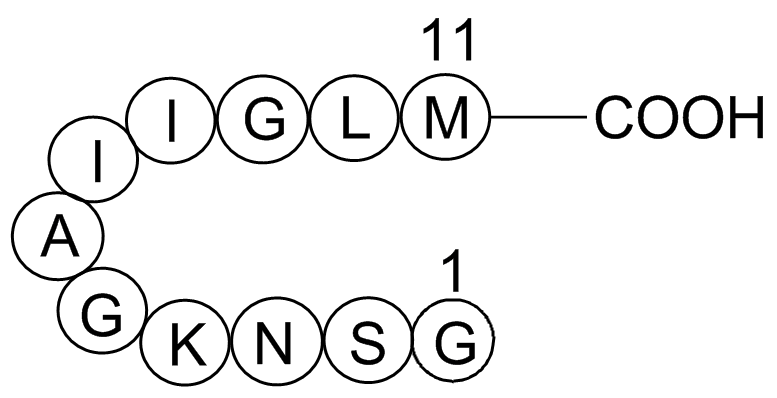
GP10082
Amyloid Beta-peptide (25-35) (human)
アミロイドβペプチド(25-35)(人間)は、神経毒性のあるアルツハイマー病のアミロイドβペプチドの断片です。
-
GC18339
Amyloid β-Peptide (1-42) human
アミロイドβペプチド(1-42)は、アルツハイマー病の発症に重要な役割を果たす、42個のアミノ酸から成るペプチドです。

-
GP10057
Amyloid β-Peptide (10-20) (human)
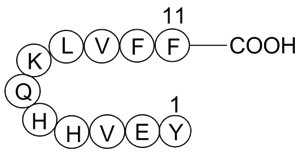
-
GP10094
Amyloid β-peptide (10-35), amide
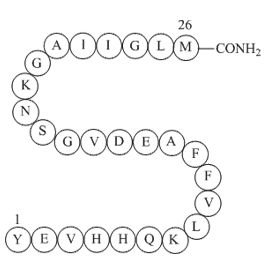
-
GP10097
Amyloid β-Protein (1-15)
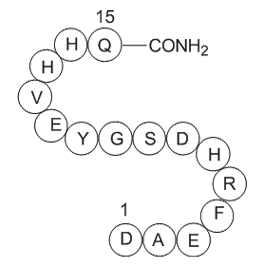
-
GC45382
Amyloid-β (1-28) Peptide (human) (trifluoroacetate salt)

-
GC42798
Amyloid-β (1-38) Peptide (trifluoroacetate salt)
アミロイドβ(1-38)(Aβ38)ペプチドは、Aβ42ペプチドの断片です。

-
GC46850
Amyloid-β (1-40) Peptide (human) (trifluoroacetate salt)
多様な生物学的活性を持つ神経ペプチド

-
GC46851
Amyloid-β (1-42) Peptide (trifluoroacetate salt)
アミロイドβの42アミノ酸タンパク質フラグメント

-
GC42801
Amyloid-β (1-8) Peptide
アミロイドβ(1-8)は、変異を含むアミロイドβ(1-8、A2V)ペプチドの野生型コントロールです。

-
GC42802
Amyloid-β (1-8, A2V) Peptide
アミロイドβ(1-8、A2V)は、アミロイドβ(Aβ)の切断形であり、Aβナンバリング規則の位置2にバリンからアラニンへの置換を含んでいます(Aβ A2V)。これは、アミロイド前駆体タンパク質(APP)ナンバリング規則の位置673に相当します(APP A673V)。

-
GC42799
Amyloid-β (17-40) Peptide (human) (trifluoroacetate salt)
アミロイドβ(Aβ)(17-40)は、α-およびγシークレターゼによるアミロイド前駆体タンパク質(APP)の翻訳後処理によって形成されるAβタンパク質の24残基フラグメントです。

-
GC42800
Amyloid-β (17-42) Peptide (human) (trifluoroacetate salt)
アミロイドβ(Aβ)(17-42)は、アミロイド前駆体タンパク質(APP)がα-およびγシークレターゼによる後翻訳処理を経て形成されるAβタンパク質の26残基フラグメントです。

-
GC40127
Amyloid-β (22-35) Peptide (trifluoroacetate salt)
アミロイドβ(Aβ)(22-35)は、人間のアミロイド前駆体タンパク質(APP)のフルレングス配列の残基693-705に対応する13個の残基からなるAβの断片です。
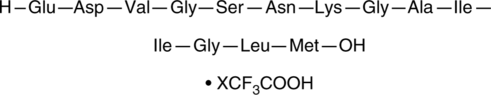
-
GC42803
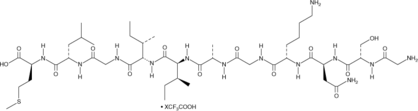
Amyloid-β (25-35) Peptide (human) (trifluoroacetate salt)
アミロイドβ(25-35)(Aβ(25-35))は、完全な長さのペプチドの物理的および生物学的特性を保持する11残基フラグメントであるAβタンパク質です。
-
GC42804
Amyloid-β (40-1) Peptide (human) (trifluoroacetate salt)
アミロイドβ(40-1)ペプチド(Aβ(40-1))は、Aβ(1-40)ペプチドの逆シーケンスを含むペプチドです。

-
GC40126
Amyloid-β Precursor Protein (96-110) Peptide (cyclized) (human) (trifluoroacetate salt)
アミロイドβ前駆体タンパク質(96-110)ペプチド(環化されたもの)は、アミロイド前駆体ペプチド(APP)のアミノ酸96〜110から構成され、位置3と10のシステイン残基間に架橋を介して環化された合成ペプチドです。

-
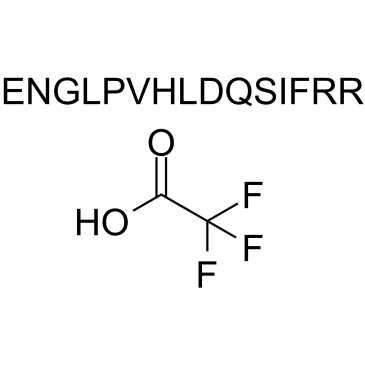
GC34471
Angiogenin (108-122) TFA
-
GC32607
Angiogenin 108-122
アンギオゲニン 108-122 は、アンギオゲニンペプチドです。
-
GC61479
Angiopep-2 hydrochloride
Angiopep-2 塩酸塩は脳ペプチドベクターです。 Angiopep-2 ペプチド ベクターとの抗癌剤の結合は、脳癌の治療における有効性を高める可能性があります。



